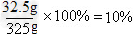问题
计算题
某校同学探究附近赤铁矿中Fe2O3的纯度。他们采集了20g样品,加入稀盐酸,恰好完全反应,共用去稀盐酸309g,过滤得到滤渣4g。(假设杂质既不溶于水,也不溶于酸;不考虑实验中的损耗)。
计算:
(1)Fe2O3在赤铁矿样品中的质量分数为多少?
(2)反应后所得溶液中溶质的质量分数是多少?
答案
解:根据题意,赤铁矿石中Fe2O3的质量为20g-4g=16g
则Fe2O3在赤铁矿石中的质量分数为
设反应后生成FeCl3的质量为x
Fe2O3+6HCl==2FeCl3+3H2O
160 325
16g x

x=32.5g
反应后所得溶液中溶质的质量分数=