问题
计算题
现有铁粉与木炭粉混合物40克,与足量的稀硫酸反应,产生标准状况下(指0℃、标准大气压强)气体1克,将反应后所得混合物进行过滤,得一定质量的滤渣。请计算:
(1)原混合物中炭粉的质量分数。
(2)将全部滤渣溶在浓硫酸中,发现其完全溶解,并放出刺激性气味气体,发生的化学议程式为:C+2H2SO4(浓、热)==CO2↑+2SO2↑+2H2O,求理论上此滤渣与热的浓硫酸反应产生的气体总质量为多少克(标准状况下,且有害气体最后集中处理)?
答案
解:(1)设原混合物中铁的质量为X
Fe+H2SO4==FeSO4+H2↑
56 2
X 1g
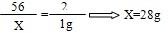
则炭粉的质量分数为:
(2)设全部炭粉与热的浓H2SO4反应产生CO2、SO2气体的质量分别为y和z。
C+2H2SO4=CO2↑+2SO2↑+2H2O
12 44 2×64
12g y z
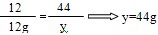
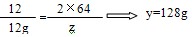
产生气体的总质量为:44g+128g=172g
答:设原混合物中铁的质量分数为30%,滤渣与热的浓硫酸反应产生的气体总质量为172g。