(14分)为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
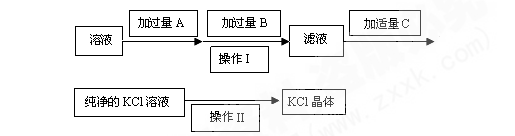
(1)写出上述试剂的化学式:A , B 。
(2) 上述操作Ⅰ所用玻璃仪器的名称是 ;
操作Ⅱ的名称是 。
(3) 加过量A时发生有关反应的离子反应方程式为:
、 。
(4)检验B是否过量的方法是
(14分)(1)A Ba(OH)2 B K2CO3 (2) 漏斗、玻璃棒、烧杯; 蒸发
(3) Mg2+ +2OH― =Mg(OH)2 ↓ 、 Mg2+ +SO42― +Ba2+ +2OH― =Mg(OH)2 ↓+BaSO4↓ 。
(4)取滤液少许,加入稀盐酸,产生气泡现象,说明K2CO3过量
题目分析:氯化镁和硫酸镁都可以用氢氧化钡除去,而过量的氢氧化钡可以利用碳酸钾除去,因此A是氢氧化钡,B是碳酸钾,过滤后用盐酸进行酸化,所以C是氯化钾。而从氯化钾溶液中得到氯化钾晶体时应该通过蒸发结晶的方法。
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则:
1. 不能引入新的杂质(水除外)。即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中。
2. 分离提纯后的物质状态不变。
3. 实验过程和操作方法简单易行。即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:
1. 分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解) ,溶解,过滤(洗涤沉淀) ,蒸发,结晶(重结晶) ,电精炼。
2. 分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏。
3. 分离提纯物是胶体:盐析或渗析。
4. 分离提纯物是气体:洗气。
