问题
计算题
为了测定黄铜屑(有锌和铜形成的合金)样品组成,甲、乙、丙、丁四位同学分别取样和稀硫酸反应(稀硫酸的密度为1.17g/mL),实验数据记录如下:
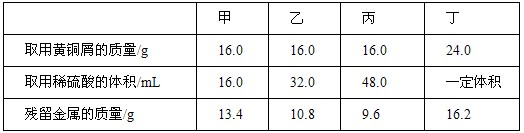
(1)上表中n的数值为________。
(2)样品中碳酸钙的质量分数是_____。
(3)求盐酸中溶质的质量分数。
答案
(1)从甲、乙、丙三位同学取稀硫酸的体积及残留金属的质量分析,丙同学取用硫酸过量。所以,16.0g黄铜屑中锌的质量为:16.0g-9.6g=6.4g
(2)设甲同学消耗硫酸的质量为x
Zn+H2SO4==ZnSO4+H2↑
65 98
16.0g-13.4g x
x=98×(16.0g-13.4g)/65=3.92g
稀硫酸的溶质质量分数为: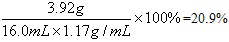
丁同学消耗锌的质量分数为:24.0g-16.2g=7.8g
设:丁同学实验消耗H2SO4的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98
7.8g y
y=11.76g
所以,丁同学取用稀硫酸的质量为11.76g/20.9%=56.27g
体积为:56.27g÷1.17g/mL=48 mL
答:(1)16.0g黄铜屑中锌的质量为6.4g
(2)丁同学所加稀硫酸的体积为48mL
