某铝合金(硬铝)中含有铝、镁、铜等,为了测定该合金中铝的含量,有人设计了如下实验:(已知:硅不与盐酸和水反应)

(1)若固体Ⅰ中含有铜,步骤①的试剂X应选择 (填“NaOH溶液”“盐酸”“FeCl3溶液”);步骤②的操作是 ,得到固体Ⅱ反应的离子方程式为
(2)固体Ⅲ的化学式为 步骤④反应的化学方程式为
(3)该铝合金中铝的质量分数是________________
(4)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果 (填“偏高”“偏低”“不影响”)
(1) 盐酸 ;过滤 ; Mg2++2OH-=Mg(OH)2↓(2) Al203 2A1(OH)3 Al203+3H20
(3)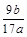 (4)偏高
(4)偏高
题目分析:铜与盐酸不反应,镁、铝与盐酸反应,X为盐酸;若X为氢氧化钠溶液,则固体I中含Mg、Cu;若X为氯化铁溶液,则固体I中无铜。步骤①过滤后的溶液中含MgCl2、AlCl3、HCl,加足量NaOH溶液后,固体II为Mg(OH)2,溶液为NaAlO2、NaCl、NaOH,向溶液中通入过量二氧化碳气体生成氢氧化铝沉淀,氢氧化铝灼烧生成固体III为Al2O3。
(1)步骤②操作为过滤;生成氢氧化镁离子方程式为Mg2++2OH-=mg(OH)2↓;
(2)固体III为Al2O3,步骤④为氢氧化铝受热分解生成氧化铝和水。
(3)由铝元素守恒知原样品中Al质量为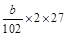 g。Al质量分数为
g。Al质量分数为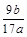 。
。
(4)步骤④中沉淀未用蒸馏水洗涤,则所得氧化铝质量偏大,测定结果偏高。
点评:熟悉常见无机物的性质。
