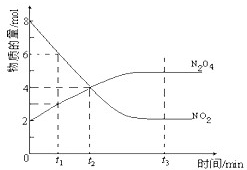
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)⇌N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:______
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率:______mol•L-1•s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:______
(4)t1时,正反应速率______(填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向______ 移动 (填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色______(填“变深”、“变浅”或“不变”)
(1)可逆反应2NO2⇌N2O4的平衡常数表达式k=
,故答案为:c(N2O4) c2(NO2)
;c(N2O4) c2(NO2)
(2)由图可知,从t1至t2时N2O4的物质的量变化量为4mol-2mol=2mol,故v(N2O4)=
=0.2mol/(L•s),2mol 1L 20s-10s
故答案为:0.2;
(3)到达平衡时,反应混合物各组分的物质的量不发生变化,由图象可知,t3时刻处于平衡状态,故答案为:t3;
(4)t1时刻后,NO2浓度降低,N2O4浓度增大,未到达平衡状态,反应向正反应进行,故正反应速率大于逆反应速率,
故答案为:>;
(5)维持容器的温度不变,缩小容器的体积,压强增大,平衡向体积减小的方向移动,即向正反应方向移动,
故答案为:正反应方向;
(6)维持容器的体积不变,升高温度,平衡向逆反应移动,NO2浓度增大,混合气体颜色变深,故答案为:变深.
