本题包括以下两小题。
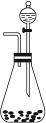
Ⅰ.右图是一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体,供选用的试剂有:
A.浓H2SO4,
B.浓盐酸,
C.食盐,
D.MnO2,E.H2O2(aq),F.KClO3,G.KMnO4溶液,试完成下列问题:(1)若要快速制备少量氧气,应选择___________(选项编号)。
(2)若要快速制备少量HCl,应选择___________(选项编号)。
Ⅱ.已知H2O2(aq)有酸性,也有漂白作用,它在MnO2的催化下可以加速分解:
①2H2O2====2H2O+O2↑
某学生查阅资料后指出Na2O2与水反应时,先生成NaOH和H2O2:
②Na2O2+2H2O====2NaOH+H2O2
此反应放出的热量,促使H2O2缓慢分解,生成O2:
③2H2O2====2H2O+O2↑
该过程的总反应方程式即为:
④2Na2O2+2H2O====4NaOH+O2↑
该同学所在的课外兴趣小组欲验证他的以上认识,实验室提供了下列仪器和药品:
仪器:试管、胶头滴管、烧杯、药匙、镊子
药品:Na2O2、水、酚酞试液、石蕊试液、MnO2
假设你是该课外活动小组的成员,请你简述实验过程,并写出实验现象和实验结论。
Ⅰ.(1)DE (2)AB
Ⅱ.①用药匙取少量过氧化钠固体加入试管中;②再逐滴加入水到不再产生气体,加适量水稀释;③将溶液一分为二,向一支试管中滴2滴酚酞试液,溶液先变红,约半分钟后红色褪去;向另一支试管中先加少量MnO2,先有气体放出,待反应完成后,再加酚酞1~2滴,溶液变红色,并持久不褪色,由此说明该同学的观点正确。若没有以上现象,则不正确。
Ⅰ.(1)制取O2,可依据下列反应原理
2H2O2====2H2O+O2↑
(2)制取HCl,可利用浓H2SO4的吸水性和溶于水放出大量热的特点,把浓H2SO4滴入浓盐酸中,使浓盐酸中挥发出HCl气体。
Ⅱ.须设置对比实验,一实验在③反应发生前放入酚酞,二实验在③反应发生后放入酚酞(可利用MnO2促使H2O2完全分解);若一实验先变红后褪色,二实验只变红不褪色,则表明该同学认识正确。
