问题
计算题
石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验。
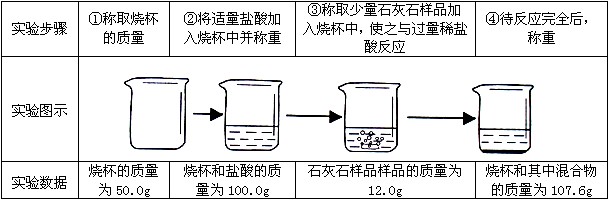
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
答案
(1)根据质量守恒定律得:m(CO2)=(100.0g+12.0g)-107.6g=4.4g
(2)设12.0g石灰石样品中含CaCO3质量为x
CaCO3+2HCl==CaCl2+CO2↑+H2O
100 44
x 4.4g
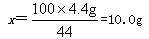
该石灰石样品的纯度为: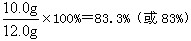
因83.3%<85%,所以该石灰石样品的纯度不符合要求。
