已知SO2和H2O2在溶液中发生反应:SO2+H2O2====H2SO4。取0.6 g某含硫、铁的物质在氧气中加热,使硫全部燃烧转化为SO2,用稀H2O2溶液吸收,吸收液用0.1 mol·L-1 NaOH溶液中和,耗去20.0 mL NaOH溶液。
(1)求此含硫、铁的物质中硫的质量分数。
(2)求此含硫、铁的物质中铁与硫的原子个数之比(取整数值)。
(1)5.33%
(2)10∶1
(1)根据已知条件可得关系式:
S—SO2—H2SO4—2NaOH
n(S)=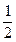 n(NaOH)=
n(NaOH)=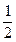 ×0.1 mol·L-1×0.02 L="0.001" mol
×0.1 mol·L-1×0.02 L="0.001" mol
w (S)="0.001" mol×32 g·mol-1×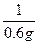 ×100%=5.33%
×100%=5.33%
(2)m(Fe)="0.6" g-0.001 mol×32 g·mol-1="0.568" g
n(Fe)=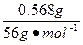 ≈0.01 mol
≈0.01 mol
n(Fe)∶n(S)="0.01" mol∶0.001 mol=10∶1。
