(1)将一束灼热的细铜丝立刻放进盛有氯气的集气瓶中,产生的现象是 ,反应的方程式是 。若将一束擦亮的细铜丝伸进装有硫蒸气的大试管内,产生的现象是 ,反应的方程式是 ,由此得出Cl2与S的氧化性比较是 。
(2)某学生在做铜丝在硫蒸气中燃烧的实验时,先将铜丝用砂纸磨光,在酒精灯上预热后迅速插入试管内靠近熔化的硫的液面上方,结果未见铜丝燃烧。实验失败的可能原因是:① ,② 。
(3)汞蒸气有毒。①万一把汞洒出,可以在溅洒有微细汞滴的部位撒一层硫磺粉,这时发生反应的化学方程式是: 。②室内有汞蒸气时,应进行通风以降低汞蒸气浓度,这时通风口装在墙的 (填“上”或“下”)部的效率高。
(4)举出两个实验事实,说明氧的非金属性比氟弱:① ;② 。
(1)棕黄色的烟 Cu+Cl2 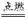 CuCl2 燃烧生成黑色的固体 2Cu+S
CuCl2 燃烧生成黑色的固体 2Cu+S 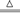 Cu2S Cl2>S
Cu2S Cl2>S
(2)①铜丝预热时表层生成的CuO隔绝了铜与硫蒸气的接触 ②熔化的硫未达到沸腾,S蒸气的浓度小,温度低
(3)①Hg+S  HgS ②下
HgS ②下
(4)①F2与H2在暗处化合,O2与H2要点燃才化合 ②F2与水反应:2F2+2H2O  4HF+O2,H2O中-2价的氧被F2氧化生成O2
4HF+O2,H2O中-2价的氧被F2氧化生成O2
(1)Cu在Cl2中燃烧生成固体小颗粒CuCl2,Cu在S蒸气中燃烧生成Cu2S。(2)应考虑S蒸气的浓度大小、反应温度等因素。(3)由于汞在常温下可与S反应,故可用此法消除少量汞引起的污染。汞的相对原子质量为200.6,远大于空气的平均相对分子质量29,所以汞蒸气的密度大于空气,在室内的下部空间存在。(4)根据氟气、氯气与氢气化合的难易、反应条件及反应的剧烈程度设计实验,此外,F2与H2O反应可以置换出氧而产生氧气。
