(10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
 已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。
已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。
请回答:(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中试剂②应该是 (填以下字母编号)。
A.氢氧化钠
B.氧化铝
C.氨水
D.水(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
。
(4)计算溶液F中c(Mg2+)= ( 25℃时,氢氧化镁的Ksp=5.6×10-12)。
(5)工业生产中将固体C灼烧后的产物与KNO3、KOH固体加热共熔制备净水剂K2FeO4,同时获得一种亚硝酸盐,请写出制得K2FeO4的化学方程式: 。
(共10分,每空2分)
(1)SiO2+2NaOH=Na2SiO3+H2O (反应物、产物写错0分;没配平,扣1分)
(2)A(多选0分)
(3)镁离子沉淀不完全及氢氧化铝溶解不完全(1个点1分)
(4)5.6× 10–10 mol/L(单位1分)
(5)Fe2O3+3KNO3+4KOH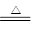 2K2FeO4+3KNO2+2H2O(物质写错0分;没配平、没条件扣1分)
2K2FeO4+3KNO2+2H2O(物质写错0分;没配平、没条件扣1分)
题目分析:(1)混合物中和盐酸不反应的是二氧化硅,即固体A是二氧化硅。二氧化硅是酸性氧化物,则二氧化硅和氢氧化钠溶液反应的化学方程式是SiO2+2NaOH=Na2SiO3+H2O。
(2)溶液B中含有铁离子、铝离子和镁离子,所以根据氢氧化物沉淀时的pH可知,如果控制pH=3.7,析出的沉淀是氢氧化铁,即固体C是氢氧化铁。溶液B中含有铝离子和镁离子,则氢氧化物沉淀时的pH和氢氧化铝溶解时的pH可知,E时氢氧化镁,F是偏铝酸盐,所以试剂②是氢氧化钠,答案选A。
(3)如果pH过小,则会导致镁离子沉淀不完全及氢氧化铝溶解不完全,所以应该可知pH=13。
(4)由于溶液中OH-的浓度是0.1mol/L,所以根据氢氧化镁的溶度积常数可知,溶液中镁离子的浓度是 。
。
(5)氢氧化铁分解生成氧化铁,所以根据原子守恒可知,制备高铁酸钾的化学方程式是Fe2O3+3KNO3+4KOH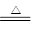 2K2FeO4+3KNO2+2H2O。
2K2FeO4+3KNO2+2H2O。
点评:该题是高考中的常见题型,试题难度较大,对学生的要求高。本题关键是明确反应的原理,理解所给的信息,然后灵活运用即可。该题有利于学生的逻辑思维能力和灵活应变能力,有利于提高学生分析问题、解决问题的能力。该题综合性强,学生不易得分。
