问题
计算题
在活动与探究实验中,老师提供了一包钾肥(包装上注明主要原因成份是硫酸钾,化学式为K2SO4,纯度为95.0%)样品给同学们,让同学们通过实验确定该样品的纯度(硫酸钾的质量分数)是否符合标准。丽丽同学称取8.0克样品,加入适量的水溶解后,与足量的BaCl2溶液充分反应,生成BaSO4沉淀,过滤、洗涤、烘干沉淀,测得其质量为9.8克,试通过计算确定该化肥的纯度是否符合包装袋上的说明(假设杂质不与BaCl2溶液反应,计算结果精确到0.1%)。
答案
解:设8.0克样品中所含K2SO4的质量为x。
K2SO4+BaCl2==BaSO4↓+2KCl
174 233
x 9.8克
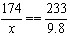
x=7.32(克)
样品中所含K2SO4的质量分数为:K2SO4%=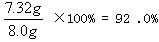
因为:92.0%小于95.0%,该化肥的纯度不符合包装袋上的说明。
