问题
计算题
取50 mL硫酸、盐酸混合溶液,当加入0.4 mol·L-1 Ba(OH)2溶液250 mL时,不再生成沉淀,但溶液仍为酸性;再加入125 mL Ba(OH)2溶液后,恰好使溶液呈中性。求该溶液中硫酸和盐酸的物质的量浓度。
答案
2 mol·L-1 2 mol·L-1
n(Ba2+)=n(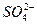 )="0.25" L×0.4 mol·L-1="0.1" mol,
)="0.25" L×0.4 mol·L-1="0.1" mol,
n(H+)=n(OH-)="2×0.375" L×0.4 mol·L-1="0.3" mol。
所以,n(H2SO4)="0.1" mol,
c(H2SO4)=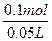 ="2" mol·L-1,
="2" mol·L-1,
n(HCl)="0.3" mol-2×0.1 mol="0.1" mol,
c(HCl)= 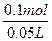 ="2" mol·L-1。
="2" mol·L-1。
