问题
计算题
某课外活动小组,为了检测本地钢铁厂生铁产品的质量,在实验中称取生铁屑样品10.0g加入烧杯中,加入一定量的稀硫酸,使之充分反应(杂质不参与反应),然后冷却称量,反应后烧杯中物质的质量比反应前减少了0.3g.试计算:
(1)生铁样品中杂质的质量.
(2)生产100t这种生铁,至少需要含四氧化三铁75%的磁铁矿石多少吨?
答案
(1)设样品中杂质的质量为x.
Fe+H2SO4==FeSO4+H2↑
56 2
10.0g﹣x 0.3g
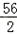 =
= ,
,
x=1.6g
(2)生铁中铁的质量分数为 ×100%=84%
×100%=84%
设需要磁铁矿石的质量为y.
Fe3O4+4CO 3Fe+4CO2
3Fe+4CO2
232 168
y×75% 100t×84%
 =
=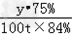 ,
,
y=154.7t
答:
(1)样品中杂质的质量为1.6g.
(2)需要磁铁矿石154.7t.
