一定温度下,在容积为VL的密闭容器里进行反应:
aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中
=______.a b
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:______.
(3)下列叙述能说明上述反应达到平衡状态的是(填序号)______
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化.
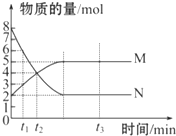
(1)有图象可知,
=a b
=△n(N) △n(M)
=(8-2)mol (5-2)mol
,故答案为:2 1
或2;2 1
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:v=
=△c(M) △t
=(4-3)mol VL (t2-t1)min
mol•L-1•min-1,故答案为:1 (t2-t1)×v
mol•L-1•min-1;1 (t2-t1)×v
(3)A、当体系达平衡状态时,M与N的物质的量之比为可能时1:1,也可能不是1:1,故A错误;
B、根据质量守恒,混合气体的总质量自始至终不发生变化,不能作为平衡状态判断的依据,故B错误;
C、随着反应进行,混合气体的总物质的量减小,当混合气体的总物质的量不随时间的变化而变化时,说明到达平衡状态,故C正确;
D、无论反应是否达到平衡,这个关系总是成立的,反应方向一致,不能作为平衡状态判断的依据,故D错误;
E、该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,说明到达平衡状态,故E正确;
故答案为:CE.
