问题
计算题
某实验小组为了测定人体呼出的气体中CO2的体积分数,设计如下实验:
第一步:收集51某同学呼出的气体样品;
第二步:在气体样品中加入过量的澄清石灰水,振荡,充分反应;
第三步:把反应后的溶液转移到锥形瓶中,慢慢滴人质量分数为5%的盐酸,到不产生气泡为止。产生气体的体积与加入盐酸的质量的关系如下图。回答下列问题:
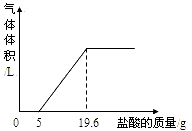
(1)加入5.0g盐酸前并没有气泡产生,原因是(用化学方程式表示):_________。
(2)加入盐酸产生CO2的总质量是多少?(溶于水中的二氧化碳忽略不计)
(3)该气体样品中CO2的体积分数是多少?(精确到0.1%。已知:常温下CO2的密度为1.96g/L。)
答案
(1)2HCl+Ca(OH)2=CaCl2+2H2O
(2)已知产生CO2所消耗的盐酸中所含HCl的质量是:
(19.6g-5.0g)×5%=0.73g
设加入盐酸产生CO2的总质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
73 44
0.739 x
根据73:44=0.73g:x ,得出x=0.44g
(3)0.44g CO2在常温下的体积为 0.44g÷1.96g/L=0.224 L
该气体样品中CO2的体积分数是0.224 L/5 L×100%=4.5%
