(10分)欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
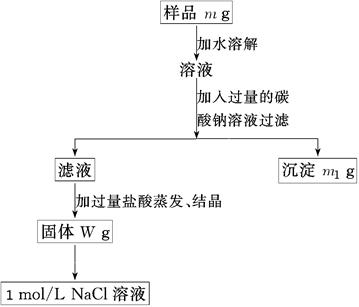
⑴称量粗盐样品m g,样品放在托盘天平左盘上。
⑵过滤时,需用到的玻璃仪器除烧杯、玻璃棒外有 。
⑶蒸发操作时应将液体放在___ ___中加热,等加热至____ ____时即停止加热。
⑷在样品的溶液中加入过量的Na2CO3溶液,作用是____________________________,反应的离子方程式是___ ___________________。
⑸在滤液中加入盐酸的作用是________ ________,发生反应的化学方程式是____ _______。
⑹配制100 mL 1mol/L的NaCl溶液时,应从W g固体中称取NaCl的质量为____________。
(10分,每空1分,方程式各2分) (2)漏斗 (3)蒸发皿 剩余较少液体
(4)使钙离子完全形成沉淀而除去 Ca2++CO32—-===CaCO3↓
(5)除去过量的Na2CO3 Na2CO3+2HCl===2NaCl+H2O+CO2↑
(6)5.9 g
题目分析:(2)过滤时,需用到的玻璃仪器除烧杯、玻璃棒外有漏斗。
(3)蒸发操作时应将液体放在蒸发皿中加热,等加热至剩余较少液体时即停止加热。
(4)氯化钠中含有氯化钙,所以在样品的溶液中加入过量的Na2CO3溶液的作用是使钙离子完全形成沉淀而除去,反应的离子方程式是Ca2++CO32—-===CaCO3↓。
(5)由于碳酸钠是过量的,所以在滤液中加入盐酸的作用是除去过量的Na2CO3,有关反应的化学方程式是Na2CO3+2HCl===2NaCl+H2O+CO2↑。
(6)100 mL 1mol/L的NaCl溶液只溶质的质量是0.1L×0.1mol/L×58.5g/mol=5.85g。由于托盘天平只能读数到0.1g,所以实际称量的质量是5.9g。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分内容主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
