Ⅰ.取3份73g某浓度的盐酸,分别加入盛有NaHCO3 和KHCO3组成的同一种混合物中,进行甲、乙、丙三组实验, 测得如下数据(不考虑CO2在水中的溶解)。
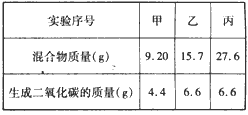
回答下列问题:
(1)盐酸的溶质质量分数为____。
(2)混合物中NaHCO3和KHCO3的质量比为____。
Ⅱ.已知固体混合物A由NaHCO3、KHCO3、MgCO3和CaCO3四种物质中的两种混合而成,通过计算和推理回答下列问题。
(1)取A与足量的盐酸反应,若A的质量为定值时,无论其组成成分的含量如何变化,生成气体的量都为定值,则A 的可能组成是(可以不填满,也可补充)

(2)若A是MgCO3和CaCO3组成的混合物,取10.0g的A与足量的盐酸反应,产生气体的质量x范围是多少?
I.(1)在甲组实验中盐酸没有完全反应,乙、丙组中盐酸完全反应,所以应选择乙或丙组CO2质量计算HCl的质量。
设73g盐酸中含HCI的质量为x。
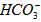 ~ HCl ~ CO2
~ HCl ~ CO2
36.5 44
x 6.6g
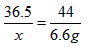 x=5. 475g
x=5. 475g
(2)设混合物中KHCO3的质量为x,NaHCO3的质量为y。
KHCO3 + HCl== KCl+H2O + CO2 ↑
100g 44g
x 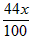
NaHCO3+ HCl==NaCl + H2O + CO2 ↑
84g 44g
y 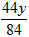
列方程式x +y =9. 2g,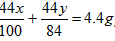
解得 x=5g,y=4.2g。
则NaHCO3与KHCO3的质量比为4.2g:5g =21:25。
Ⅱ.(1)要使混合物组合发生反应生成CO2的量是定值,那么组分的相对分子质量应相同,组分中含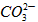 的质量分数也相同。
的质量分数也相同。
NaHCO3和MgCO3,KHCO3和CaCO3两组符合上述条件。
(2)解:设10.0g的A中只含有MgCO3,它与足量盐酸反应产生的CO2的质量为a,
设10g A中只含有CaCO3,它与足量盐酸反应产生的CO2的质量为b。
MgCO3 +2HCl==MgCl2 + CO2 ↑ +H2O
84 44
10.0g a
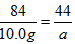 ,a=5. 24g。
,a=5. 24g。
CaCO3 +2HCl==CaCl2 +CO2 ↑ +H2O
100 44
10.0g b
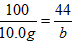 ,b=4. 40g。
,b=4. 40g。
所以,产生气体的质量x范围是4. 40g<x<<5.24g
