合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ/mol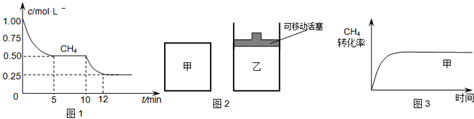
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为______;10min时,改变的外界条件可能是______.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应CO(g)+H2O(g)⇌CO2(g)+H2(g)800℃时,反应的化学平衡常数K=1.0.
①某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆)b.v(正)<v(逆)c.v(正)=v(逆)d.无法判断
②800℃时,向体积为2L的密闭容器中充入2molCO和4molH2O,求达到平衡时CO的转化率.
(1)由图可知,由图可知,在5~10分钟、12分钟后,甲烷浓度不变,是平衡状态;10min时甲烷的浓度继续减小,该反应向正反应方向移动,而该反应为吸热反应,则升高温度符合题意,
故答案为:5~10分钟、12分钟后;升高温度;
(2)甲、乙两容器中分别充入等物质的量的CH4和CO2,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CH4+CO2⇌2CO+2H2,其体积增大,则相当于压强减小,化学平衡向正反应方向移动,乙容器中CH4的转化率增大,但压强小,反应速率减慢,则达到平衡的时间变长,则乙中CH4的转化率随时间变化的图象为:
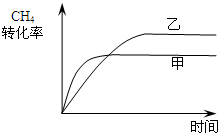 ,
,
故答案为: ;
;
(3)由表格中的数据可知,气体的体积相同,则物质的量与浓度成正比,Qc=
<K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a,2.0×2.0 2.0×8.5
故答案为:a;
②800℃时,反应的化学平衡常数K=1.0,向体积为2L的密闭容器中充入2mol CO和4mol H2O,设参加反应的CO为xmol;
CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始量(mol):2 4 0 0
转化量(mol):x x x x
平衡量(mol):2-x 4-x xx
K=
=c(CO2)c(H2) c(CO)c(H2O)
=1,
•x 2 x 2
•2-x 2 4-x 2
所以x=
mol,4 3
所以平衡时CO的转化率为:
×100%=66.7%,
mol4 3 2mol
答:达到平衡时CO的转化率66.7%.
