某矿抽出的废液中含有大量的K+、Cl—、Br—,还有少量的Ca2+、Mg2+、SO42—。某研究性学习小组所拟取这种废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
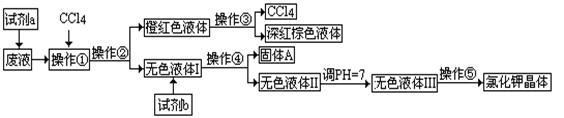
可供试剂a、b的选择试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。
请根据以上流程,回答相关问题:
(1)试剂a应该选用_______________;
(2)操作①、②、③、④、⑤的名称是_________(填字母)。
A.萃取、过滤、分液、过滤、蒸发结晶
B.萃取、分液、蒸馏、过滤、蒸发结晶
C.分液、萃取、过滤、过滤、蒸发结晶
D.萃取、分液、分液、过滤、蒸发结晶(3)除去无色液体I中的Ca2+、Mg2+、SO42-离子,选出C所代表的试剂,按滴加顺序依次是 (填化学式)。
(4)调节pH的作用是 ,操作方法是 。
(5)操作⑤中用到的瓷质仪器名称是 。
(1)H2O2
(2)B
(3)BaCl2、KOH、K2CO3(只要K2CO3在BaCl2之后即可)
(4)除去溶液中过量的CO32-;取少量的PH试纸置于玻璃片上,用蘸有待测溶液的玻璃棒点滴在试纸的中部,待试纸变色后,再与标准比色卡比较来确定溶液的pH
(5)蒸发皿
本题综合考查了高中化学的的混合物的分离与提纯的方法,是考查学生基本实验能力的一道好题。
废液中含有Br-,要转化为Br2,要加入氧化剂,不能引入新的杂质,所以试剂a是H2O2;加入CCl4的目的是萃取;紧接着萃取后的操作是将有机层与水层分开,叫做分液;从含有溴的CCl4溶液中分离得到CCl4和液溴的操作,是将两种相互混溶的液体进行分离的操作,叫做蒸馏;操作③完成后得到固体A和无色液体I,该操作是过滤,分离互不相溶解的固体和液体;操作④是从溶液中得到能溶解于水的氯化钾晶体,是蒸发结晶。用KOH溶液与Ca2+、Mg2+反应生成Ca(OH)2、Mg(OH)2,除去Mg2+和大部分Ca2+,用BaCl2溶液与SO42—反应生成BaSO4而除去Ba2+,最后用饱和的K2CO3除去余下的少量Ca2+和后来加入的Ba2+,此处不能选用Na2CO3溶液,否则会引入新的Na+,K2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+。
