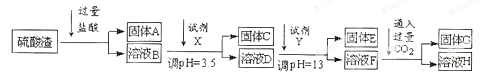
硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。 某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离开来。
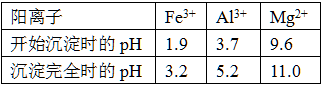
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)工业上用固体A作原料制取粗硅的化学方程式为 。
(2)实验室用11.9mol/L的浓盐酸配制250mL3.0 mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要 。
(3)上述流程中的试剂Y最好选用下列中的 (选填字母编号)。
A.水
B.氧化镁
C.氨水
D.氢氧化钠(4)写出反应F→H的离子方程式 。
(5)溶液H显碱性,原因是 (用离子方程式和必要的文字说明)。
(6)实验室可用大理石和稀盐酸反应制取上述流程中所需的CO2,仪器如下,装置A产生CO2,按气流方向连接各仪器接口,顺序为a→ ,装置C中应 盛放的试剂为 。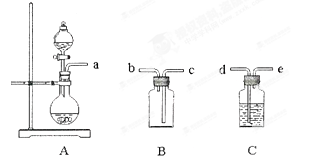
(1)2C+SiO2 Si+2CO↑
Si+2CO↑
(2)250mL容量瓶、胶头滴管 (每个1分,容量瓶无规格不得分) (3)D
(4)AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-(或[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-) (5)HCO3- CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,HCO3-的水解程度大于电离程度
H2CO3+OH-,HCO3-的水解程度大于电离程度
(6)→d→e→c→b 饱和NaHCO3溶液
题目分析:(1)以粗硅的制取为背景,考查学生捕捉、获取情境信息的能力,结合所学知识可知利用焦炭还原二氧化硅来制取粗硅。要求学生掌握硅的相关性质,正确书写焦炭与二氧化硅反应的方程式。
(2)考查一定物质的量浓度溶液的配制所需仪器的选择,除题中所给仪器外,还需250mL容量瓶和胶头滴管。要求学生掌握一定物质的量浓度溶液的配制实验。
(3)考查阳离子Mg2+以氢氧化物形式沉淀所需试剂的选择,根据题给信息和流程可知应该先用氢氧化钠液将Mg2+转化成氢氧化镁沉淀析出同时将Al3+转化成AlO2-(或[Al(OH)4]-)为后续流程做铺垫。
(4)考查AlO2-(或[Al(OH)4]-)与CO2反应离子方程式的书写,要求学生应清楚过量CO2反应的产物并正确书写离子方程式。
(5)考查NaHCO3溶液显碱性的原因分析,学生应清楚仅存在水解平衡,也存在电离平衡,NaHCO3溶液之所以显碱性是因为HCO3-的水解程度大于HCO3-的电离程度。
(6)考查CO2气体的实验室制备、除杂、收集方法。学生需根据实验室制备CO2的原理将所给仪器进行合理地组装。利用大理石和稀盐酸本来反应得到的CO2气体中会混有HCl气体气质,应通过盛有饱和NaHCO3溶液的洗气瓶来除去;CO2气体密度大于空气,2的制备以及水解原理的应用
点评:该题是高考中的常见题型,属于中等难度的试题。该题综合性强,侧重对学生实验能力的培养,提高学生的学科素养。有利于培养学生规范、严谨的实验设计、评价能力以及操作动手能力。该题需要明确的这种类型的试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
