接触法制H2SO4的基本原理是:
①4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
②2SO2+O2  2SO3
2SO3
③SO3+H2O  H2SO4
H2SO4
其中排放的尾气含少量SO2,为防止污染大气,在排放前应设法进行综合利用。
(1)某硫酸厂每天排放10000m3(换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL2mol·L-1的NaOH溶液使其完全反应,经测定所得溶液含16.7g溶质。试分析溶液的成分,并计算各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3,调节尾气排放的流量,以取得SO2和NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且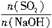 =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
| x=n(SO2)/n(NaOH) | n(NaHSO3) |
 Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2  aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
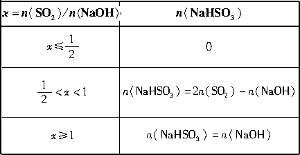
(1)设得CaSO4·2H2O的质量为y。
根据S元素守恒有:
SO2 ~ CaSO4·2H2O
22.4L 172g
104×103×0.2%L y
y=153.6kg
(2)若溶质全为Na2SO3,则反应为
2NaOH+SO2  Na2SO3+H2O
Na2SO3+H2O
m(Na2SO3)=126g·mol-1×2×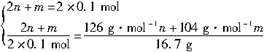 mol=12.6g
mol=12.6g
若溶质全为NaHSO3,则根据反应
NaOH+SO2  NaHSO3
NaHSO3
m(NaHSO3)=104g·mol-1×2×0.1mol=20.8g
由于20.8>16.7>12.6,所以溶质为Na2SO3和NaHSO3的混合液。
设混合物中NaHSO3的物质的量为m,Na2SO3的物质的量为n。
解法一:
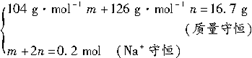
解之,得:m=0.1mol,n=0.05mol
解法二:用配平方程式计算
(2n+m)NaOH+(m+n)SO2  nNa2SO3+mNaHSO3+nH2O
nNa2SO3+mNaHSO3+nH2O
则有
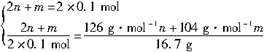
m=0.1mol n=0.05mol
(3)SO2通入NaOH溶液时可能发生的反应为
2NaOH+SO2  Na2SO3+H2O(Ⅰ)
Na2SO3+H2O(Ⅰ)
NaOH+SO2  NaHSO3(Ⅱ)
NaHSO3(Ⅱ)
①当x=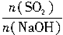 ≤
≤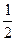 时,反应按(Ⅰ)式进行,SO2全部反应,生成物皆为Na2SO3,故n(NaHSO3)=0。
时,反应按(Ⅰ)式进行,SO2全部反应,生成物皆为Na2SO3,故n(NaHSO3)=0。
②当x=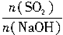 ≥1时,反应按(Ⅱ)式进行,NaOH全部反应,生成物全是NaHSO3,有n(NaHSO3)=n(NaOH)。
≥1时,反应按(Ⅱ)式进行,NaOH全部反应,生成物全是NaHSO3,有n(NaHSO3)=n(NaOH)。
③当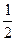 <x<1时,(Ⅰ)(Ⅱ)两个反应平行进行,NaOH与SO2两物质均耗尽,生成NaHSO3和Na2SO3的混合物。〔由(2)步的分析可有〕
<x<1时,(Ⅰ)(Ⅱ)两个反应平行进行,NaOH与SO2两物质均耗尽,生成NaHSO3和Na2SO3的混合物。〔由(2)步的分析可有〕
n(NaHSO3)+2n(Na2SO3)=n(NaOH) (Na+守恒)
n(Na2SO3)+n(NaHSO3)=n(SO2) (S守恒)
解之,得n(NaHSO3)=2n(SO2)-n(NaOH)
