问题
计算题
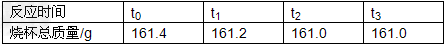
小可同学为测定某铁合金的含铁量,做了如下实验,称取11.4克样品,放入质量为50.0克的烧杯中,再往烧杯中加入100.0克的稀盐酸(杂质不与酸反应、不溶于水)并对烧杯进行了四次称量,记录数据如下:
求:
(1)反应产生的氢气的质量
(2)该铁合金中铁的质量分数(保留一位小数)
答案
(1)分析题干给出的数据以及表格的数据可知此反应进行完全,根据质量守恒定律,可得产生氢气的质量为:11.4g+100g+50g﹣161g=0.4g
(2)设产生0.4g氢气需要铁的质量为x,则有
Fe+2HCl==FeCl2+H2↑
56 2
x 0.4g
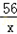 =
=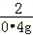
x=11.2g
所以铁的质量分数为: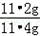 ×100%=98.2%
×100%=98.2%
答:反应产生的氢气的质量为0.4g,该铁合金中铁的质量分数为98.2%.

