问题
计算题
把一包含有杂质的铁粉样品分成质量相等的两份(杂质不溶于水,且不参与反应).若向其中一份中加入足量的稀盐酸,充分反应后应得到0.4g不溶物;向另一份中加入足量的氯化铜溶液,充分反应得到不溶物3.6g.求原样品中铁粉的质量.
答案
解:由于两次混合物中不溶物的质量差为3.2g,所以为生成的铜的质量.
设与氯化铜溶液反应的铁粉质量为x
Fe+CuCl2==FeCl2+Cu
56 64
x 3.2g
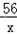 =
=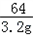
x=2.8g
原样品中铁粉的质量=2.8g×2=5.6g
答:原样品中铁粉的质量为5.6g.
