问题
计算题
称取生铁屑13g放入烧杯中,加入一定量的稀硫酸充分反应(杂质不反应),反应后生成氢气0.4g,计算:
(1)生铁样品中,铁的质量分数,
(2)消耗20%的硫酸多少克.
答案
解:设生铁样品中铁的质量为x,消耗硫酸的质量为y
Fe+H2SO4==FeSO4+H2↑
56 98 2
x y 0.4g
56:2=x:0.4g,
解之得 x=11.2g
98:2=y:0.4g,
解之得 y=19.6g
生铁样品中铁的质量分数=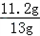 ×100%=86.1%
×100%=86.1%
消耗20%的硫酸的质量=19.6g ×20%=98g
答:
(1)生铁样品中,铁的质量分数为86.1%;
(2)消耗20%的硫酸98g.
