问题
计算题
把铁和铜的混合物样品,分成等质量的两份.一份与过量的稀硫酸反应生成氢气0.4g,在另一份中加入足量的硫酸铜溶液,反应后所得不溶性固体质量为21.6g,求:
(1)原混合物样品中铁多少克?
(2)原混合物中铜的质量分数?
答案
(1)设生成0.4g氢气消耗铁的质量为x
Fe+H2SO4==FeSO4+H2↑
56 2
x 0.4g
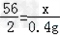
x=11.2g
原混合物样品中铁的质量=11.2g×2=22.4g;
(2)设11.2g铁完全反应置换出铜的质量为y
Fe+CuSO4==FeSO4+Cu
56 64
11.2g y
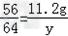
y=12.8g
原混合物样品中铜的质量=(21.6g﹣12.8g)×2=17.6g
原混合物中铜的质量分数= =44%
=44%
答:
(1)原混合物样品中铁为22.4g;
(2)原混合物中铜的质量分数为44%.
