问题
计算题
在12.4克硫酸钠及碳酸钠的混合物,加入适量的水溶解,在该混合溶液中加入稀硫酸后有气体放出,直到不再产生气体时为止,用去稀硫酸溶液49克,已知H2SO4的质量分数为10%;在反应后的溶液中继续加入足量的氯化钠溶液,有白色沉淀生成.求:
(1)加入稀硫酸后生成硫酸钠的质量;
(2)加入氯化钠溶液后,生成白色沉淀的质量.
答案
解:(1)设反应消耗碳酸钠的质量为x,生成硫酸钠的质量为y
Na2CO3+H2SO4 == Na2SO4+H2O+CO2↑
106 98 142
x 49g×10% y
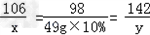
解得:x=5.3g y=7.1g
所以反应后硫酸钠的总质量为:12.4g﹣5.3g+7.1g=14.2g
(2)设生成硫酸钡的质量为z,
Na2SO4+BaCl2==2NaCl+BaSO4↓
142 233
14.2g z
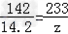
解得:z=23.3g
答:(1)加入稀硫酸后生成硫酸钠的质量为7.1g;
(2)加入氯化钠溶液后,生成白色沉淀的质量为23.3g
