某部分变质的NaOH试剂经处理后只含有NaOH和Na2CO3两种物质.小明同学从中均匀取出9.3g样品用19.9g水溶解后,再向其中缓慢滴加10%的稀盐酸至恰好完全反应时,用去稀盐酸73g,经测定共放出气体2.2g.
(1)向样品中加入稀盐酸至恰好完全反应时,发生的两个反应可用化学方程式表示为 _________ 9.3g样品中,含有Na2CO3的质量为_________g,含NaOH的质量为_________g.
(2)通过计算确定原NaOH试剂的变质程度.(用质量百分数表示)
(3)上述恰好完全反应后的溶液中,溶质的质量分数是多少?(用百分数表示,保留一位小数)
(1)NaOH+HCl═NaCl+H2O、Na2CO3+2HCl═2NaCl+CO2↑+H2O;5.3g;4g.
(2)设变质生成5.3gNa2CO3的NaOH质量为x.
2NaOH+CO2==Na2CO3+H2O
80 106
x 5.3g
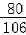 =
=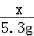
x=4g
则原NaOH试剂的变质程度为: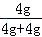 ×100%=50%
×100%=50%
答:原NaOH试剂的变质程度为50%;
(3)设9.3g样品与稀盐酸反应后共生成的NaCl的质量为y,由(1)中反应方程式可知生成的NaCl与所用的HCl的关系为
NaCl~HCl
58.5 36.5
y 73 g×10%
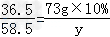
y=11.7 g
反应后溶液的质量为:9.3 g+19.9 g+73 g﹣2.2 g=100 g
反应后的溶液中溶质的质量分数为: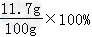 ×100%=11.7%
×100%=11.7%
答:反应后溶液中溶质的质量分数为11.7%.
