在酸性条件下:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2;
②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原成I2.
(1)上述反应所涉及到的粒子氧化性最强的是______ (填离子符号);
(2)写出一个能证明氧化性Br2>I2的离子方程式______;
(3)向含有KI、H2SO4的溶液中加入KBrO3溶液,若氧化产物、还原产物只有I2和Br2,写出反应的化学方程式,并标明电子转移方向和数目.______;其中被氧化的元素是______,要得到1mol还原产物转移电子数目为______.
(1)①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2,则氧化性:KBrO3>KIO3,②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,则氧化性:KIO3>Br2,所以氧化性最强的是KBrO3,故答案为:BrO3-;
(2)反应Br2+2I-=I 2+2Br-,氧化性Br2>I2的,故答案为:Br2+2I-=I 2+2Br-;
(3)向含有KI、H2SO4的溶液中加入KBrO3溶液,若氧化产物、还原产物只有I2和Br2,反应中KI被氧化失去电子,得电子被还原KBrO3,电子转移方向和数目可表示为:
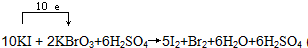
,要得到1mol还原产物Br2,转移的电子数目为:2×(5-0)×6.02×1023=6.02×1024,
故答案为:
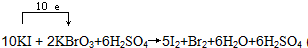
;-1价I;6.02×1024.
