某化学兴趣小组用化学方法测定一种钢样品中铁的含量.同学们称取了5.7g钢样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量也为10.0g)中.在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如下表:
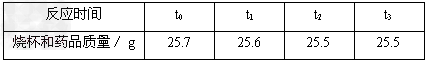
(1)反应中产生氢气 _________ 克,这种钢样品中铁的含量是多少?(精确到0.1%)
(2)钢的类型分为:含碳质量(C%)0.03%~0.3%为低碳钢;0.3%~0.6%为中碳钢;0.6%~2%为高碳钢.假设残留在烧杯中的黑色固体全部是炭,则这种钢属于 _________ .
(3)有同学提出:灼烧可使钢中的炭变为CO2挥发掉,灼烧后钢样品质量会减轻.可是他们将一定量的钢样品灼烧后,发现质量反而增加了很多.原因是 _________ .
(1)根据质量守恒定律,反应中产生氢气质量=5.7g+10.0g+10.0g﹣25.5g=0.2g
设5.7g钢样品中含铁质量为x,则:
Fe+2HCl==FeCl2+H2↑
56 2
x 0.2g
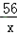 =
=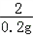
x=5.6g
则这种钢样品铁的含量=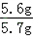 ×100%=98.2%
×100%=98.2%
(2)该钢样中含碳量=1﹣98.2%=1.8%,0.6%<1.8%<2%,所以属于高碳钢
(3)钢中含碳量少,所以碳减少的质量,远小于铁转化为氧化物增加的质量
