(11分)有一瓶无色气体可能含有H2S、CO2、HBr、SO2、Cl2中的一种或几种,将其通入稀氯水中得无色透明溶液,将溶液分成两份,向一份中加入用稀HNO3酸化的AgNO3,生成白色沉淀,向另一份中加入用盐酸酸化的BaCl2溶液,也生成白色沉淀。
(1)原气体中肯定含有____________________________,可能含有
____________________________。
(2)对可能含有的成分,请你设计一套简单合理的实验方案,并具体说明在此方案中,气体通过的各装置的作用。
(1)SO2 CO2
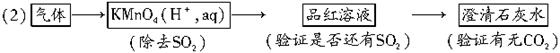
(1)因为气体为无色气体,所以不含Cl2。该气体通入稀氯水中得无色透明溶液,证明不含H2S和HBr,含SO2。因为,如果含H2S,则发生下列反应:
H2S+Cl2====2HCl+S↓
生成的S会使溶液变浑浊;如果含有HBr,则会发生下列反应:
2HBr+Cl2====2HCl+Br2
生成的Br2会使溶液显黄色(或橙色);如果不含SO2,就不会发生下列反应:
SO2+Cl2+2H2O====2HCl+H2SO4
不发生上列反应,就不会除去氯水中的Cl2,所得溶液就不会无色,而是浅黄绿色。
将该气体通入氯水中所得溶液为稀HCl(aq)和稀H2SO4(aq)的混合溶液,加入AgNO3(aq)生成AgCl沉淀:
Ag++Cl—====AgCl↓
加入BaCl2(aq)生成BaSO4沉淀:
Ba2++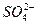 ====BaSO4
====BaSO4
由此也能证明原气体肯定含有SO2,CO2可能含有,也可能不含有。
(2)欲验证CO2,可除去SO2,将验证不含SO2的剩余气体通过足量石灰水,石灰水变浑浊,证明含CO2;石灰水不变浑浊,证明不含CO2。
