学校化学实验室买来了几包纯碱供大家做试验用,大鹏仔细看了包装说明(如图),并产生“说明是否真实”的疑问?他取一小包纯碱样品进行实验:准确称取11g样品放入烧杯中,在滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸50g.得固液混合物质量为57g(杂质不溶于水且与盐酸不反应). 请回答下列问题:

(1)写出反应的化学方程式 _________ ;
(2)求解该样品中参加反应的碳酸钠质量?
(3)该样品中碳酸钠的质量分数为?
(4)向反应后的固液混合物中加入143.4g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为?
(5)欲配制150g上述实验所用的稀盐酸,需要36.5%的浓盐酸质量为?
(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)根据质量守恒定律,反应生成二氧化碳的质量=11g+50g﹣57g=4g,
设样品中碳酸钠的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
x 4g
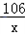 =
=
解得x=9.64g
(3)样品中碳酸钠的质量分数=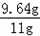 ×100%≈87.6%
×100%≈87.6%
(4)设反应生成氯化钠的质量为y
Na2CO3+2HCl==2NaCl+H2O+CO2↑
117 44
y 4g
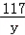 =
=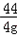
y≈10.64g
所得不饱和溶液中溶质的质量分数=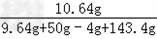 ×100%≈5.35%
×100%≈5.35%
(5)设50g稀盐酸中HCl的质量为z
Na2CO3+2HCl==2NaCl+H2O+CO2↑
73 44
z 4g
 =
=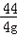
z≈6.64g
则150g这样的稀盐酸中HCl质量=6.64g× =19.92g
=19.92g
需要36.5%的浓盐酸质量=19.92g÷36.5%≈54.58g≈55g
