某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu,稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s),浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液 | H2 | H2O |
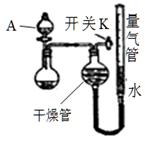
(1)仪器A的名称是 。
(2)实验Ⅰ反应的离子方程式是 。
(3)实验Ⅱ中量气管中的液体最好是 ( )(填字母编号,下同)
a.浓NaOH溶液 b.煤油 c.氨水 d.氯化铵溶液
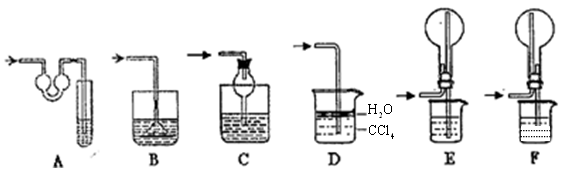
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有( )
(4)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温.②视线与凹液面最低处相平.③ 。
(5)实验Ⅲ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
(15分)(前3空每空2分,后3空每空3分)
(1)分液漏斗
(2)3Cu + 8H++ 2NO3- = 3Cu2+ + 2NO↑+ 4H2O
(3)b A、C、D、F
(4)使量气管与干燥管两端液面相平
(5)27%
题目分析:(1)考查常识知识,仪器A的名称是分液漏斗。
(2)根据题中所给出的反应物和生成物书写离子方程式为3Cu + 8H++ 2NO3- = 3Cu2+ + 2NO↑+ 4H2O。
(3)氨气易溶于水,故错b。BE装置溶液发生倒吸,故错。故选ACDF。
(4)还需要注意的是要使量气管与干燥管两端液面相平。
(5)②中的属于与其它相差大,舍去不用,用①③中的数据计算,实验Ⅲ中,Mg和NaOH溶液不反应,Al与NaOH溶液反应产生H2,通过计算H2的体积为336mL, H2物质的量为0.015mol,根据2Al~3H2计算,Al的物质的量为0.01mol,Al的质量为0.27g,故镁铝合金中铝的质量分数为27%。
点评:本题考查了测定气体体积的方法,难度大,易错题是量气管中液体的选择,选择标准是和该气体不反应。
