问题
计算题
某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方程式Fe2O3+3CO 2Fe+3CO2)
2Fe+3CO2)
答案
解:设需要含氧化铁80%的赤铁矿的质量为x
3CO+Fe2O3  2Fe+3CO2
2Fe+3CO2
160 112
x80% 1120t×95%
x=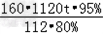 =1900t
=1900t
答:需要含氧化铁80%的赤铁矿1900吨.
某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方程式Fe2O3+3CO 2Fe+3CO2)
2Fe+3CO2)
解:设需要含氧化铁80%的赤铁矿的质量为x
3CO+Fe2O3  2Fe+3CO2
2Fe+3CO2
160 112
x80% 1120t×95%
x=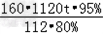 =1900t
=1900t
答:需要含氧化铁80%的赤铁矿1900吨.