问题
计算题
用CO还原赤铁矿(主要成分是Fe2O3)样品12g,将反应生成的CO2气体,全部通过入过量的石灰水中,生成白色沉淀15g,试计算原赤铁矿中氧化铁的质量分数.
答案
设生成3.0g碳酸钙需要二氧化碳的质量为x
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
x 1.5g
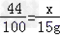 x=6.6g
x=6.6g
设生成6.6g二氧化碳需要Fe2O3的质量为y
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
160 132
y 6.6g

y=8g赤铁矿样品中Fe2O3的质量分数为: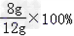 =66.67%
=66.67%
答:赤铁矿样品中Fe2O3的质量分数为66.67%

