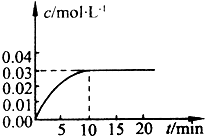
在某一容积为5L的密闭容器内,加入0.2molCO和0.2molH2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H(g)△H>0,反应中CO2的浓度随时间变化情况如图所示:
(1)根据图中数据,反应开始至达到平衡时,CO的化学反应速率为______,反应达平衡时,c(H2)=______.
(2)判断该反应达平衡的依据是______(填序号).
①CO减少的速率和CO2减少的速率相等
②CO、H2O、CO2、H2等浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
④该条件下正、逆反应速率都为零
(3)如果一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,在相同条件下,反应达平衡时,c(H2O)=______.
(1)v(CO2)=
=△C △t
=0.003mol/(L.min),同一时间段内同一可逆反应中,各物质的反应速率之比等于其计量数之比计算一氧化碳的平均反应速率,所以v(CO)=v(CO2)=0.003mol/(L.min);反应达到平衡状态时,c(CO2)=c(H2)=0.03mol/L,0.03mol/L 10min
故答案为:0.003mol/(L.min);0.03mol/L;
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,
①CO减少的速率和CO2减少的速率相等,该反应的正逆反应速率相等,所以该反应达到平衡状态,故正确;
②根据图象知,该反应达到平衡状态时,c(CO2)=c(H2)=0.03mol/L,则c(CO)=c(H2O)=
-0.03mol/L=0.01mol/L,当CO、H2O、CO2、H2等浓度都相等时,该反应未达到平衡状态,故错误;0.2mol 5L
③CO、H2O、CO2、H2的浓度都不再发生变化时,该反应达到平衡状态,故正确;
④该条件下,可逆反应达到平衡状态时,正逆反应速率相等但不等于0,故错误;
故选①③;
(3)如果一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,与开始时加入0.2molCO和0.2molH2O为等效平衡,则两种条件下,达到平衡状态时其水的物质的量浓度相等,所以达到平衡状态时,c(H2O)=
=0.2mol-0.03mol/(L.min)×10min×5L 5L
-0.03mol/L=0.01mol/L,0.2mol 5L
故答案为:0.01mol/L.
