某一含铜6.4克、锌6.5克、铁5.6克、铝2.7克的金属粉末混合物,与一定质量的稀硫酸反应.待反应停止后,经实验测得尚有9.2克固体没有反应掉.求:
(1)可得氢气多少升?(已知该条件下2克氢气占体积22.4升)
(2)生成硫酸亚铁多少克?
(1)根据题意可知,有6.5克Zn、2.7克Al、5.6g﹣2.8g=2.8克铁和硫酸完全反应了;设锌与硫酸反应生成氢气质量为x,铁与硫酸反应生成氢气质量为y,铝与硫酸反应生成氢气质量为z,
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5g x
Fe+H2SO4=FeSO4+H2↑
56 2
2.8g y
2Al+3H2SO4=Al2(SO4)3+3H2↑,
54 6
2.7g z
∴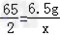 ,
,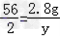 ,
,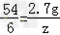
∴x=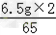 =0.2g,y=
=0.2g,y=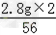 =0.1g,z=
=0.1g,z=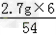 =0.3g,
=0.3g,
∴可得氢气的质量为:0.2g+0.1g+0.3g=0.6g;22.4L÷2g×0.6g=6.72L;
(2)设生成硫酸亚铁的质量为r,
Fe+H2SO4=FeSO4+H2↑
152 2
r 0.1g
因为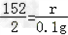 所以r=
所以r=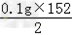 =7.6g.
=7.6g.
答:(1)可得氢气6.72L;
(2)生成硫酸亚铁的质量为7.6g.
