问题
计算题
100g某硫酸恰好与13g锌完全起反应,试计算:
(1)生成氢气的质量;
(2)该硫酸中溶质的质量分数;
(3)反应后所得溶液中溶质的质量分数(保留到0.1%).
答案
解:设硫酸溶液中溶质的质量为x,生成硫酸锌的质量为y,生成氢气的质量为z
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
13g x y z
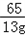 =
=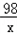 x=19.6g
x=19.6g
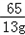 =
=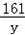 y=32.2g
y=32.2g
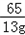 =
= z=0.4g
z=0.4g
硫酸溶液中溶质的质量分数=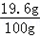 ×100%=l9.6%
×100%=l9.6%
硫酸锌溶液的溶质质量分数=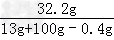 ×100%=28.6%
×100%=28.6%
答:(1)生成氢气的质量为0.4g;
(2)硫酸溶液中溶质的质量分数为19.6%;
(3)反应后所得溶液中溶质的质量分数为28.6%.
