问题
计算题
某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,俊充分反应,实验数据如下:
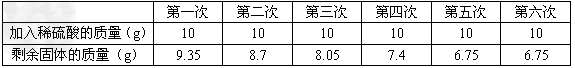
(1)黄铜样品中锌的质量分数为多少?(写出计算步骤,下同)
(2)所用稀硫酸的质量分数为多少?
答案
⑴ 由表中数据知该 合金中铜的质量为6.75g,则锌的质量为3.25g
合金中铜的质量为6.75g,则锌的质量为3.25g
黄铜样品中锌的质量分数为 3.25÷10×100%=32.5%
⑵ 设稀硫酸中溶质质量为x
Zn + H2SO4 ==== ZnSO4 + H2↑
65 98
3.25g x
65∕3.25g=98∕x
x=4.9g 

稀硫酸中溶质质量分数为 4.9g∕50g×100%=9.8% 
答:略
