问题
问答题
已知:KClO3+NH4NO2→KCl+NH4NO3
(1)指出以上反应中的氧化剂是______,被氧化的元素是______;
(2)配平上述反应方程式并标明电子转移的方向和数目______.
答案
(1)反应KClO3+NH4NO2→KCl+NH4NO3中,化合价降低的Cl元素所在的反应物KClO3是氧化剂,
化合价升高的NH4NO2中+3价的N元素在反应中被氧化,故答案为:KClO3;N;
(2)在氧化还原反应KClO3+NH4NO2→KCl+NH4NO3中,化合价升高的N元素失去2mol电子,化合价降低的Cl元素得到6mol电子,得失电子相等,即反应中转移的电子为6mol,根据电子守恒来配平方程式为:KClO3+3NH4NO2═KCl+3NH4NO3,电子转移情况为:
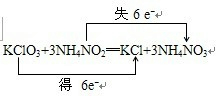
,故答案为:

.
