问题
计算题
下图是“×××”钙片商品标签图.
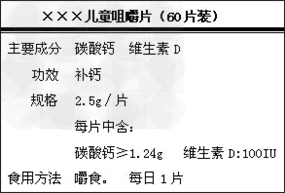
(1)主要成分为碳酸钙的相对分子质量为多少?每片中至少含钙元素的质量为多少克?
(2)小芳同学为了测定其碳酸钙的含量标注是否属实,她取出6片片剂,研碎后放入烧杯中,加入稀盐酸,至不再产生气体为止.共用去稀盐酸40g,称量烧杯里剩余物质质量为51.7g(钙片中其它成分不与稀盐酸反应)试求:
①生成二氧化碳的质量.
②通过计算判断钙片中碳酸钙的含量标注是否属实.
(相对原子质量 Ca﹣40 C﹣12 O﹣16)
答案
(1)碳酸钙的相对分子质量为:40+12+16×3=100
每片钙片中至少含钙元素的质量为1.24g× ×100%=0.496g
×100%=0.496g
(2)根据质量守恒定律得,生成的二氧化碳的质量为:2.5g×6+40g﹣51.7g=3.3g
设6片钙片中所含的碳酸钙的质量为x
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 3.3g
 =
=
x= =7.5g
=7.5g
则每片钙片中碳酸钙的质量为 =1.25g>1.24g
=1.25g>1.24g
故钙片中碳酸钙的含量标注是属实的
答:(1)碳酸钙的相对分子质量是100,每片钙片中至少含钙元素的质量为0.496g
(2)生成的二氧化碳的质量为3.3g,通过计算该钙片中碳酸钙的含量标注是属实的.
