问题
计算题
把14.8 g氯酸钾和二氧化锰组成的固体混合物放到大试管中加热,反应完全后,冷却到反应前的温度,称得试管中固体物质的质量为10.0 g。试求:
(1)生成氧气的质量。
(2)原混合物中氯酸钾的质量。
(3)请你分析随着反应的进行,大试管内固体混合物中二氧化锰的质量分数大小变化趋势为____,其原因是____;反应完全后,固体混合物中二氧化锰的质量分数为___________。
答案
(1)生成氧气的质量为14.8 g-10.0g=4.8 g。
(2)解:设原混合物中氯酸钾的质量为x,则:
2KC1O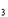
 2KCl+3O
2KCl+3O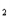 ↑
↑
245 96
x 4.8 g
 ,
,
解得x=12. 25 g
(3)逐渐变大; 随着反应的进行,二氧化锰固体的质量不变,而氯酸钾分解产生的氧气逐渐放出,致使大试管内固体质量逐渐减小;25. 5%
