在t℃时149克10%的氯化钾溶液跟108.8毫升(密度为1.25克/毫升)硝酸银溶液恰好完全反应.试计算:
(1)有多少克硝酸银参加反应?
(2)反应后溶液中溶质的质量分数是多少?
(3)若将上述反应后的溶液过滤,把滤液加热,使其蒸发掉173.6克水,再冷却至t℃时,有0.2克无色晶体析出,求该溶液的溶质在t℃时的溶解度.
解:硝酸银和氯化钾恰好完全反应,可以根据氯化钾的质量计算,氯化钾的质量为:149g×10%=14.9g
设参加反应的AgNO3的质量为x,生成AgCl沉淀的质量为y
KCl+AgNO3==AgCl↓+KNO3
74.5 170 143.5
14.9g x y
 =
=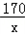 x=34g
x=34g
 =
=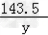 y=28.7g
y=28.7g
(2)反应后生成KNO3的质量为:14.9g+34g﹣28.7g=20.2g.
反应后硝酸钾溶液的质量是:149克+108.8毫升×1.25克/毫升﹣28.7克=256.3克.
所以反应后溶液中溶质的质量分数为: ×100%=7.9%;
×100%=7.9%;
(3)反应后的溶液过滤,把滤液加热,蒸发掉173.6克水,再冷却至t℃时,有0.2克无色晶体析出,说明此时是硝酸钾的饱和溶液;此时滤液中硝酸钾的质量是20.2g﹣0.2g=20g,硝酸钾饱和溶液中水的质量是256.3g﹣173.6g﹣20.2g=62.5g;
设t℃时硝酸钾的溶解度是m则有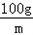 =
=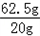 解得m=32g.
解得m=32g.
答:(1)有34克硝酸银参加反应;
(2)反应后溶液中溶质的质量分数7.9%;
(3)硝酸钾在t?时的溶解度是32克;
