问题
问答题
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
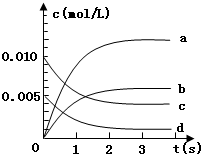
(2)如图中表示NO2的变化的曲线是______
用O2表示从0~2s内该反应的平均速率v=______
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是______
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
答案
(1)升高温度,平衡向吸热反应方向移动,NO2的浓度减小,则平衡向逆反应方向移动,所以正反应是放热反应,
故答案为:放;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,
0~2s内v(NO)=
mol/(L.min)=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为 0.0015mol/(L•s),0.020-0.008 2 2
故答案为:b,0.0015mol/(L•s);
(3)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故正确;
d.选择高效催化剂能增大反应速率,但平衡不移动,故错误;
故选c.
