用下图装置可以进行测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。气体发生装置中所涉及反应的化学方程式为:Na2SO3(s) + H2SO4 → Na2SO4 + H2O + SO2↑。
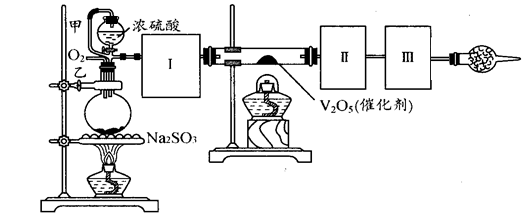
根据题意完成第35~40题:
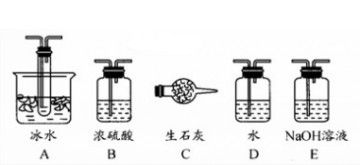
35.根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是________、_________、_________。
36.从乙处均匀通入O2,为使SO2有较高的转化率,实验中在:①加热催化剂;②滴加浓硫酸的顺序中,应采取的操作是先_______后_________(填编号)。
37.在制取SO3的过程中,若温度过高,SO2的转化率会 (填“升高”、“不变”或“降低”)。
38.实验结束后,如果取出收集SO3的仪器并敞口露置于空气中,能够看到的现象是:
__________。
39.该实验一般使用较浓的硫酸制SO2,不可使用稀硫酸,简述其原因:___________。
40.用a mol Na2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了b g,则实验中SO2的转化率为 (用含a、b的代数式填写)。
35.B、A 、E (3分)
36.①;②。(2分)
37.降低。(1分)
38.试管口有白雾。(2分)
39.稀硫酸含水较多,SO2易溶于水。(2分)
40.(1-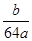 ) ×100% (2分)
) ×100% (2分)
35.Ⅰ装置必须要对二氧化硫进行干燥,可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,可以用冰水冷却来获得三氧化硫;未反应掉的二氧化硫对空气会产生污染,可以用碱石灰或者氢氧化钠溶液来进行尾气处理,故答案为:B; A;E(或C);
36.为保证产生的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再滴入浓硫酸;37.SO2转化成SO3的过程为放热,升高平衡向逆向移动,转化率SO2的转化率会降低,
故答案为:36.①;②;37.降低;
38.实验结束后,如果取出收集SO3的仪器并敞口露置于空气中,能够看到的现象是:试管口有白雾。故答案为:试管口有白雾。
39.该实验一般使用较浓的硫酸制SO2,不可使用稀硫酸,简述其原因:稀硫酸含水较多,SO2易溶于水。故答案为:稀硫酸含水较多,SO2易溶于水。
40.根据硫原子守恒,Na2SO3~SO2~SO3,amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,应产生二氧化硫的质量为64ag,测得装置Ⅲ增重了bg,即为剩余二氧化硫的质量,所以参加反应的二氧化硫的物质的量为:64ag-bg转化率α= (64a―b)/64×100%=(1600a-25b)/16a%,故答案为: (1600a-25b)/16a或(1-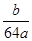 ) ×100%.
) ×100%.
