工业生产纯碱的过程如下:
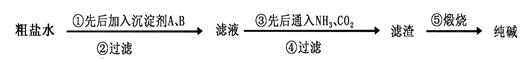
完成下列填空:
(1)粗盐水(含杂质离子Mg2+、Ca2+),加入沉淀剂A、B除杂质(A来源于石灰窑厂),则沉淀剂B 的化学式为 。
(2)实验室模拟由滤液制备滤渣的装置如下:
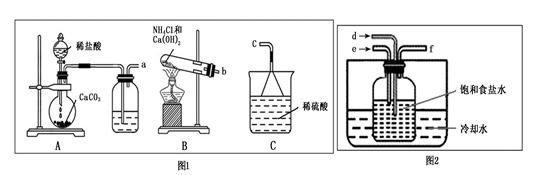
①图1中装置和图2中装置的连接方法为a接 ,b接 ,f接c。
②图2中试剂瓶内发生的化学反应方程式为 。
③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是 。
(3)操作⑤煅烧后的纯碱中含有未分解的碳酸氢钠。某同学称取该纯碱样品m g,再充分加热至质量不再变化时称得剩余固体的质量为n g,则纯碱样品中碳酸钠的质量分数为 。
(4)现有25℃下,0.1mol/LNH3·H2O溶液和0.1mol/LNH4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,下列说法正确的是 (填代号)。
a.0.1mol/L NH4Cl溶液与混合后溶液中导电粒子的种类和数目均相同
b.混合后的溶液中,c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c.由题意可知,NH3·H2O的电离程度大于同浓度的NH4Cl的水解程度
d.混合前两份溶液的pH之和大于14
(14分)(1)Na2CO3(2分)(2)①d(2分),e(2分)
② NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl(2分)
③用蘸有浓盐酸的玻璃棒靠近管口f,若有白烟生成,说明氨气过量;或用湿润的红色石蕊试纸靠进
管口f,若试纸变蓝,说明氨气过量(其他合理答案均得分)(2分)
(3)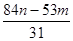 ×100%(其他合理答案均得分)(2分) (4) c d(2分)
×100%(其他合理答案均得分)(2分) (4) c d(2分)
题目分析:(1)杂质离子Mg2+、Ca2+分别用OH-和CO32-除去。由于A来源于石灰窑厂,则A是生石灰。由于不能引入新的杂质,则B应该是Na2CO3。
(2)①A装置是制备CO2,B装置是制备氨气的。由于氨气极易溶于水,直接通入溶液中容易引起倒吸,所以正确连接应该是a接d,b接e,f接c。
②图2中试剂瓶内是制备碳酸氢钠的,所以发生反应的化学反应方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
③氨气是碱性气体,能使湿润的红色石蕊试纸变蓝,也能和氯化氢反应生成氯化铵而冒白烟,所以检验通入的NH3已过量的实验操作是用蘸有浓盐酸的玻璃棒靠近管口f,若有白烟生成,说明氨气过量;或用湿润的红色石蕊试纸靠进管口f,若试纸变蓝,说明氨气过量。
(3)碳酸氢钠分解的方程式是
2NaHCO3 Na2CO3+H2O+CO2↑ △m↓
Na2CO3+H2O+CO2↑ △m↓
2×84g 106g 62g
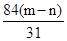 g (m-n)g
g (m-n)g
则纯碱样品中碳酸钠的质量是mg-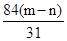 g=
g=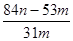 g
g
所以纯碱样品中碳酸钠的质量分数为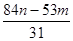 ×100%
×100%
(4)0.1mol/L NH4Cl溶液与混合后溶液中导电粒子的种类相同,但数目不同,a不正确;25℃下,0.1mol/LNH3·H2O溶液和0.1mol/LNH4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,溶液新碱性,这说明氨水的电离程度大于NH4+的水解程度,因此混合后的溶液中c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+),b不正确,c正确;0.1mol/LNH3•H2O溶液显碱性和0.1mol/LNH4Cl溶液显酸性,NH4+的水解程度小于氨水的电离程度,混合前两份溶液的pH之和大于14,故d正确,答案选cd。
