问题
计算题
有一表面被氧化的镁条3.2克跟54.6克稀H2SO4恰好完全反应生成H2 0.2克.计算:
①镁条中含单质镁多少克?
②表面被氧化的镁条中镁元素的质量分数是多少?
答案
①解:设要生成H2 0.2克需要镁的质量为X则:
Mg+H2SO4=MgSO4+H2↑
24 2
X 0.2g
根据: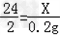
解得X=2.4g
答:镁条中含单质镁的质量为2.4g。
②氧化镁的质量为:3.2g﹣2.4g=0.8g
氧化镁中镁元素的质量:0.8×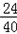 =0.48g,则表面被氧化的镁条中镁元素的质量是0.48g+2.4g=2.88g.
=0.48g,则表面被氧化的镁条中镁元素的质量是0.48g+2.4g=2.88g.
表面被氧化的镁条中镁元素的质量分数是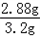 ×100%=90%
×100%=90%
答:表面被氧化的镁条中镁元素的质量分数是90%。
