(14分)某同学想通过利用下图所示装置(夹持装置略去)实验,探究SO2与Na2O2反应的产物
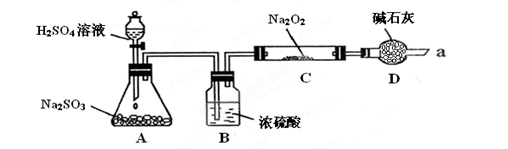
请分析:Ⅰ.装置B的作用 装置D的作用
Ⅱ.如何检验反应中是否有O2生成
Ⅲ.对C中固体产物提出如下假设:假设1:只有Na2SO3 假设2:只有Na2SO4
假设3:
(1)若按假设2进行,反应方程式为
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:
得出结论:假设2成立
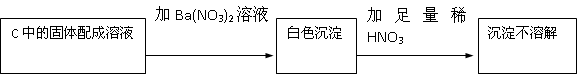
该方案是否合理 (填“是”或“否”),理由是
(3)若假设2成立,反应前后C管增加6.4g ,请计算10g含有杂质的Na2O2固体中,Na2O2的质量分数为 (所含的杂质不与SO2发生反应)

(1) Na2O2 + SO2 ="==" Na2SO4 
Ⅰ、浓硫酸有吸水性,能吸收二氧化硫中的水分,防止水蒸气与过氧化钠反应而干扰二氧化硫;碱石灰是干燥剂,能吸收水分,防止水蒸气的干扰;碱石灰是碱性物质,能吸收二氧化硫等酸性气体,防止污染大气,故答案为:干燥SO2气体,防止水蒸气与Na2O2反应;防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,同时吸收过量的SO2,以免污染空气;
Ⅱ、用带火星的木条可检验氧气,故答案为:用带火星的木条靠近干燥管口a,观察其是否燃烧;
Ⅲ、推理法可以推出:假设3:是含有亚硫酸钠和硫酸钠的混合物,故答案为:有Na2SO3和Na2SO4;
(1)过氧化钠和二氧化硫反应生成硫酸钠的原理方程式为:Na2O2+SO2=Na2SO4,故答案为:Na2O2+SO2=Na2SO4;
(2)生成的白色沉淀中如果含有亚硫酸钡,加入硝酸后,会将之氧化为硫酸钡,不能得出结论:产物是Na2SO4,故答案为:否;HNO3有氧化性,据此不能确定产物是Na2SO3还是Na2SO4或二者兼有;
(3)如果根据(m2-m1)等于参加反应的SO2质量,推断生成Na2SO3的质量为(m2-m1)×126/64g,但是该反应中吸收SO2同时有O2产生,所以( m 2-m 1)不等于参加反应的SO2质量,故该推算不合理,故答案为:因为该反应中吸收SO2同时有O2产生,所以(m2-m1)不等于参加反应的SO2质量,故该推算不合理;
(4)若假设2成立,过氧化钠和二氧化硫的反应为:Na2O2+SO2=Na2SO4,则增重等于参加反应的SO2质量,则参加反应的Na2O2物质的量n(Na2O2)= =0.1mol,质量为7.8g,质量分数为78%;
=0.1mol,质量为7.8g,质量分数为78%;
点评:本题考查了常见气体的制取和实验装置的选择,是一道综合知识题目,难度较大.
