某校化学小组的同学将一批废弃的线路板简单处理后,得到Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备强酸铜和硫酸铝晶体的方案:
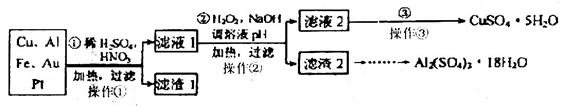
回答下列问题:
(1)第②步加入H2O2是为了除云Fe2+,该反应的离子方程式为_________;
(2)滤渣2的主要成分是Fe(OH)3和Al(OH)3。由滤渣2制取Al2(SO4)3·18H2O实验过程的最后步骤是__________________。
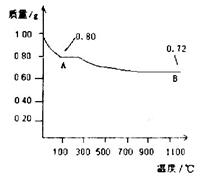
(3)用第③步所得CuSO4·5H2O可制得Cu(OH)2。化学活动小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验过程:取0.98g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图所示,产物A、B的化学式分别为____和Cu2O。通过以上实验和图像可以得出如下结论:高温时B______(填“较稳定”或“不稳定”)。
活动小组同学还进行了如下实验:
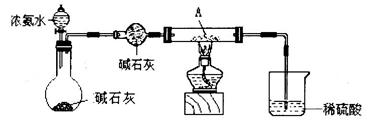
①甲同学用下列装置进行实验(夹持装置末画出),最终得出的结论是加热时A可将NH3氧化为N2,A被还原为单质Cu,支持甲同学结论的现象是______;
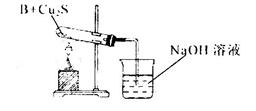
②乙同学用下列实验装置进行实验,实验中观察到混合粉末最终变成红色物质,同时生成一种无色、有刺激性气味的气体,该气体化学式为_______;有人认为乙同学的实验装置中在装B物质的试管与烧杯之间需加一个防倒吸装置,你认为是否有必要_____,若有必要请简述原因并加以改进____________。
(15分)(1)2Fe2++H2O2+4OH-=2Fe(OH)3(2分)
(2)过滤、洗涤、干燥(2分,只答对一个不得分,对2各得1分)(3)CuO(2分);较稳定(2分)
①硬质玻璃管中黑色固体变成红色,烧杯中导管口部分产生气泡,有无色、无味气体生成(2分)
②SO2(2分);需要(1分);实验中因为反应产生SO2气体易于NaOH溶液反应,会使体系内压强急剧减小造成倒吸(1分)。在导管末端连接一倒置得漏斗(1分),漏斗边缘刚刚没于液面下(1分);(或导管末端连接一干燥管,在干燥管得尖嘴部分插于液面下;气体合理答案也得分)
题目分析:(1)亚铁离子具有还原性,双氧水具有氧化性,在碱性条件下,将亚铁离子氧化生成氢氧化铁而除去,反应得离子方程式是2Fe2++H2O2+4OH-=2Fe(OH)3。
(2)氢氧化铝是两性氢氧化物,所以由氢氧化铁和氢氧化铝制备硫酸铝的主要操作是:滤渣2溶解在氢氧化钠溶液,过滤得到氢氧化铁固体,然后向滤液中进入适量的稀硫酸生成硫酸铝,然后蒸发浓缩、冷却结晶即可,所以实验过程的最后步骤是过滤、洗涤、干燥。
(3)A固体的质量是0.80g,因此在加热过程中固体减少0.98g-0.80g=0.18g。由于0.98g氢氧化铜中水的质量是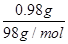 ×18g/mol=0.18g,这说明A固体恰好是氧化铜,化学式是CuO。氧化铜继续加热又生成氧化亚铜,这说明在高温下,氧化亚铜比氧化铜较稳定。
×18g/mol=0.18g,这说明A固体恰好是氧化铜,化学式是CuO。氧化铜继续加热又生成氧化亚铜,这说明在高温下,氧化亚铜比氧化铜较稳定。
①氧化铜可将NH3氧化为N2,同时氧化铜被还原为单质Cu,所以支持甲同学结论的现象是硬质玻璃管中黑色固体变成红色,烧杯中导管口部分产生气泡,有无色、无味气体生成。
②由于该气体是无色、有刺激性气味的气体,所以根据物质的组成元素可知,该气体是SO2。由于实验中因为反应产生SO2气体易于NaOH溶液反应,会使体系内压强急剧减小造成倒吸,所以在导管末端连接一倒置的漏斗,漏斗边缘刚刚没于液面下以防止倒吸,所以是有必要的。2的性质、倒吸装置的选择等
