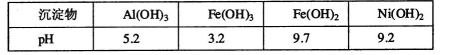
某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al203、Fe及其他不溶于酸、碱的杂质。部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
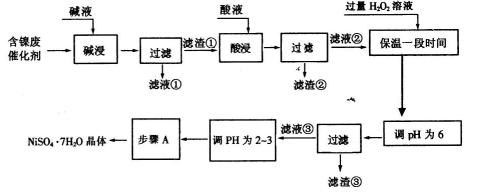
欲从含镍废催化剂中制得NiSO4·7H2O晶体,其流程如下:
请根据以上信息和流程图,回答下列问题:
(1)“碱浸”的目的是除去含镍废催化剂中的___ _。
(2)“酸浸”时所加入的酸是___ _。酸浸后,滤液②中可能含有的金属离子是___ 。(用离子符号表示)。
(3)“调pH为2—3的目的是___ _。
(4)步骤A的操作顺序是加热浓缩、冷却、____、____。
(5)NiSO4在强碱溶液中用NaC1O氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为________。
(13分)(1)Al、Al2O3(2分) (2)H2SO4(2分);Ni2+、Fe2+(2分)
(3)防止在浓缩结晶过程中Ni2+水解(2分) (4)结晶、过滤(2分)
(5)2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O(3分)
题目分析:(1)“碱浸”过程中是为了除去铝及其氧化物Al2O3,铝和氧化铝都可以和强碱反应,溶解得到偏铝酸盐,反应的离子方程式分别为2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+3H2O。
(2)“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO4•7H2O,因此加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;镍、铁和稀硫酸反应生成硫酸亚铁、硫酸镍溶液,因此滤液②中可能含有的金属离子是Ni2+、Fe2+。
(3)硫酸镍溶液需要蒸发浓缩结晶析出,为防止镍离子水解生成氢氧化镍沉淀,需要控制溶液pH。
(4)步骤A的操作顺序是加热浓缩、冷却、结晶、过滤。
(5)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,因此该反应的离子方程式是2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O。
